不同益生菌給與途徑的分析與探討∼著重於一個醫師的順勢胃腸內灌注益生菌的前瞻式研究經驗的分享(初報)

作者/1宏恩醫院綜合胃腸肝膽科 2麻醉科 譚健民1 陳臺森
前言
1907年,俄國學者Élie Metchnikoff首先在保加利亞居民中,觀察並發現在其所攝取的發酵牛乳中含有「乳酸菌」,並得知這種乳酸菌可以抑制消化道內的有害細菌,且其與該居民普遍存有長壽的現象有關,而由此宣稱乳酸菌具有益於人類健康及促進壽命延長的功效。直到1965年才由DM Lilly與RH Stillwe二位學者提出益生菌(probiotics)名稱的概念。
根據國際衛生組織WHO及聯合國糧食� �業組織FAO對益生菌的定義,指出益生菌是指某些活生生的微生物,而臨床上個體「適度足量」的給與益生菌,則可對宿主產生健康效應(The term "probiotic" as originally defined by FAO/WHO refers to "live microorganisms that, when administered in adequate amounts, confer a health benefit on the host")1。
益生菌服用的適宜時機
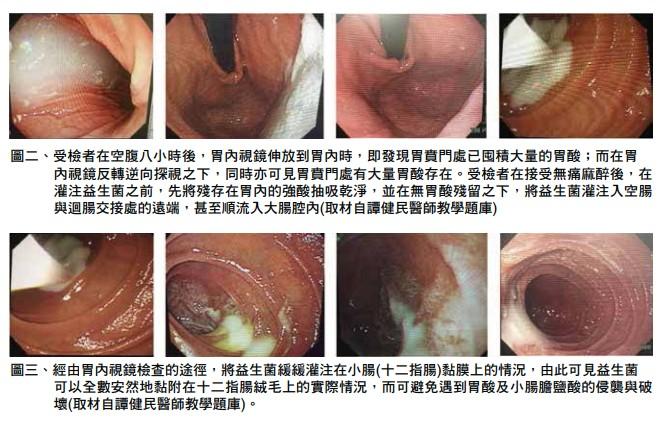
在空腹施行胃內視鏡檢查時,即可在賁門(胃的上部位置)遇見到胃酸,並可見胃賁門處存有大量胃酸(圖一)。因此,在市面上的各式各樣所謂含有益生菌的健康食品,或是口服益生菌的醫療用製劑中,一旦經由口服在胃腸道行進當中,其本身必然會先受到胃酸及膽鹽等不等程度的所當其衝的侵襲與破壞2。

「糞菌移植」給與大腸內益生菌灌注的臨床啟示5
基本上,糞菌移植(fecal microbiota transplantation, FMT)又稱之為糞菌治療(fecal bacteriotherapy)或腸菌移植(intestinal microbiota transplantation),其觀念起源於公元3,000多年前的中國,而其主要的理論基礎是將糞便中所存在的細菌再度重新放置回腸道管內6。事實上,「糞菌移植」的主要理論基礎是先將適量健康正常人的新鮮糞便與生理食鹽水一起攪拌混合均勻形成懸浮液後,並將其過濾的糞水再度灌注於存有腸道疾病罹患者的腸管內,其主要是藉由糞便中所存在含有正常隨機性並具有功能的腸道益生菌群,來抑制病患腸道中的有害菌群,以作為其腸道疾病的輔助治療,而由此達到改善及調整患者腸道內微生物生態環境的完整性為目的,此亦謂之糞便移植療法的宗旨與目的所在。
近年來,更可經由大腸纖維內視鏡檢查過程中,將糞水直接灌注入結腸的近端如盲腸或升結腸處,使得糞水中生存的益生益更能安然� ��定的移植在大腸黏膜上。此時此刻,「大腸內灌注益生菌」的理論基礎儼然而生,其在臨床上的成效以及其所扮演的角色的立基點,也就顯而易見了,而「大腸內灌注益生菌」的臨床經驗的成效,則使得益生菌的給與途徑扮演著重要的角色了7。
本院自2012年底起,開始首次嘗試經由大腸內灌注益生菌來給與被診斷為激燥性腸道症侯群(Rome III Diagnostic Criteria )病人中,在初期階段都獲不等程度的症狀緩解,現時已收集近1,259例各式各樣具有胃腸道症狀的胃腸疾病個案,其中包括有典型激燥性腸道症侯群(58例)、術後腸沾黏併發部分腸阻塞並伴隨便祕或腹瀉者、非特異性嚴重腹脹者(腹部x光攝影呈現異常過多的腸氣者)以及頑固性胃食道逆流疾病者。
< br>
附註:激躁性腸道症候群的大腸內灌注益生菌(intracolonic instillation of probiotics)輔助治療的實況影片說明8-10。
經胃內視鏡途徑灌注益生菌的臨床意義7,8
基本上,個體由口服途徑來攝取益生菌時,其中益生菌難免會遇到胃酸及小腸膽鹽酸的侵襲與破壞,因此益生菌要如何避開高胃酸的時段是很重要的。根據臨床醫學試驗結果,顯示口服益生菌不論其是以發酵乳型態存在或是特殊單獨醫療型菌株口服的攝取,其最終能存活在盲腸(大腸啓端)的存活機會約在20-40%之間不等。如此,經由胃大腸內視鏡灌注的途徑,在個體益生菌的給與方式中,扮演著舉足輕重的角色。
近年來,亦有臨床醫師在經由胃纖維內視鏡檢查的過程中,首先將胃內胃酸盡量抽取出來,然後將內視鏡管深插入到十二指腸第二部份以下,並遠離總膽管及胰管共同出口處即十二指腸乳頭(ampulla of Vater),再順勢將相關的益生菌灌注入十二指腸管腔內,如此益生菌更可以因而避免受到胃酸、膽鹽酸的破壞,而能得以存活下� �並抵達大腸管腔內。有鑒於此,經胃內視鏡途徑灌注益生菌亦具有其實際臨床實用的意義了(圖二、三)。
大腸內灌注益生菌的優勢9
大腸內灌注益生菌(intracolonic instillation of probiotics)的好處在哪裡呢?由臨床實務經驗得知,在經由胃腸內視鏡檢查過程中,給與益生菌的灌注其效益確實比口服益生菌途徑來得更為顯著,胃腸內益生菌灌注可將益生菌數量在一個很短的時間內,即時達到其與病原菌的黃金比例(6:1),如此更能即時展現其對人體的利益,由於上消化道(胃及小腸)及下消化道(大腸)存有不同的菌種,胃 腸內灌注可以選擇明確需求的菌種,雖然目前對所灌注入內的益生菌的數量尚未得到一致性的共識,但個體化的考量才是最重要的決定,亦即因人因病而有所差異。
大腸內灌注益生菌的臨床使用意義10
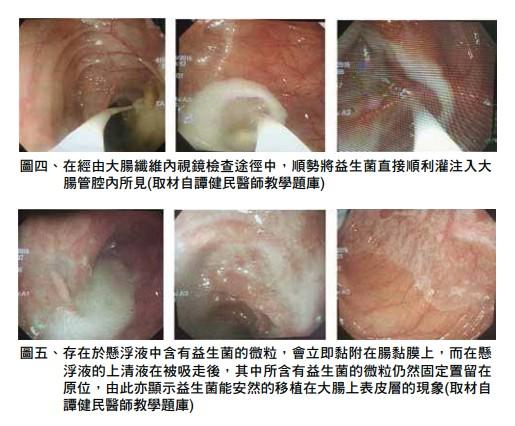
由於益生菌本身在胃中容易受到高度胃酸以及小腸中膽鹽甚至胰液等各種消化液的共同侵襲與破壞,最終其能夠到達大腸腸管內,並因而得以成功移植在大腸黏膜上的或然率也僅於5~10%之間。換言之,將益生菌直接經由大腸纖維內視鏡的檢查過程中,灌注到某個特定部位的大腸管腔,並使其即時移植在大腸黏膜上的一種臨床治� �方式,已成為目前臨床作業上益生菌給與的必要考慮輔助療法(圖四、五)。由此步驟可以避免益生菌因經由口服方式途徑,而受到胃內強酸以及小腸內鹼性膽鹽及胰液消化液的破壞,而無法達成全數移植到大腸黏膜上的目的。
因此,倘若個體本身就被醫師建議可嘗試口服益生菌使用做為一種輔助治療方式,而能使益生菌攝取者在長期持續服用中得到很好的療效,此時建議其不妨接受一次「大腸內灌注益生菌」的治療;由於益生菌可直接黏著在大腸黏膜上,益生菌成功移植率則幾達百分之百,不僅因而提升益生菌的使用效益,更可降低往後需經常口服益 生菌所衍生龐大的經濟負擔。根據個體的主觀症狀,服用者本身亦可以知道何時需要再補充口服益生菌之不足,此外亦可由其主治醫師在考量病患的客觀表徵來決定何時再服用益生菌。
不同益生菌給與途徑及其效益之比較
基本上,益生菌一旦移植在大腸黏膜上後,即以二分裂法的無性繁殖方式來進行快速繁殖,其會呈指數級增生,並形成肉眼可見的集合體(即菌落, colony),其本身並無所謂的壽命而言,菌落在腸道生存與否,則決定於生存環境的溫度、酸鹼值、氧氣成分以及營養,只要有良好適當的生存環境,而不受到外界的破壞因素如抗生素、胃酸、膽鹽的侵襲,則益生菌可以在胃腸道中持續衍繁下去。因此,個體何時再需要服用益生菌,更沒有一個明確的時間表,比方說有些人只要2~3天就有明顯腸道症狀的改善,有些人則需要好幾個星期或以上才有緩解的現象,因此腸道內灌注益生菌後,個體更應有良好持續的養菌習性,如此宿主才能營造對益生菌良好的生存環境,才能灌注入的益生菌在腸道內生生不息衍繁下去。因此,個體在服用益生菌後,倘若需� �時亦可間歇性自行追加某些補充劑量,如在服用抗生素治療以及腸道症狀再次出現時。總之,益生菌服用的持續時間以及何時需要服用益生菌是因人而異的。
表一 不同益生菌給與途徑及其效益之比較表8-11

結� �及未來展望
由本院前瞻式研究已顯示,在激燥性腸道症候群病患的使用中,大腸內灌注益生菌已有初步的成效,期待在未來進一步的隨機雙盲對照試驗(randomized clinical trial, RCT)的臨床研究中,更能再進一步了解此種新興大腸內灌注益生菌臨床步驟,更有其實質上意義及效應。無可厚非的,益生菌的給與已成為近代醫學的新興治療趨勢12,13。理論上,倘若要展現益生菌本身固有的功效,是在有機會接受大腸纖維內視鏡檢查過程中,並順勢給與大腸內灌注益生菌,如此才能達到百分百的將益生菌安置在小腸(即迴腸)及大腸起端的盲腸交界部位,使得益生菌能夠安然的移植在大腸上表皮層,才能確實發揮益生菌固有的效應。因此,在以益生菌(而非所謂的養生保健食品級益生菌)為臨床疾病防治的項目選擇中,「大腸內灌注益生菌」或許是目前最佳的首選給途徑(表一)。
此外,人們在口服益生菌當中,其不僅要先面對胃酸、膽鹽及消化液的侵襲破壞後,才能夠安然移植到大腸黏膜表面上,在此過程中必然需要個體在一時間能大量食用益生菌,也由於如此難以克服的困境,使得口服益生菌很難在一時間,能達到益生� ��數量上壓倒性的理想比例,更甭談所謂的益生菌對健康的成效了;反之,「大腸內灌注益生菌」則沒有如此疑慮,因其會全數灌注入大腸管腔內而得以移植成功的。總之,在原有實證醫學基礎上,經由大腸纖維內視鏡檢查的途徑,將益生菌順勢灌注進入大腸管腔內,也就成了一種新興並可行的治療方式了。
誌謝
特別感謝宏恩綜合醫院無痛麻醉胃腸內視鏡胃腸道癌症篩檢醫療團隊的每一位成員:消化系外科(沈國樑醫師、朱紀洪醫師、朱志純醫師、糠榮誠醫師)、消化系統內科(譚健民醫師、黃雪蓮醫師)、麻醉科(陳臺森醫師、張婉芬醫師、柯雅欽醫師、陳怡樺專科麻醉護理師)、開刀房(吳嘉珍護理長)、急診室(許瑞珊護理長)、內視鏡室(簡如鈴護理師、黃維 君護理師、高敏馥護理師),不僅由此提升全大腸纖維內鏡的完全檢查率,也使得可經由大腸纖維內視鏡檢查的途徑,將益生菌順勢灌注進入大腸管腔內的理論得以如願呈現出來,筆者特此附文表達內心十二萬分的謝意。也特別感謝台大醫院翁昭旼教授在百忙之中給與本研究中寶貴的意見,在此也一併表達感謝之情。
參考文獻
2.Marteau P, Minekus M, Havenaar R, et al: Survival of lactic acid bacteria in a model of the stomach and small intestine: validation and the effects of bile. J Dairy Sci 1997; 80: 1031-7.
3.Fuochi V, Petronio GP, Lissandrello E, et al: Evaluation of resistance to low pH and bile salts of human Lactobacillus spp. isolates. Int J Immunopathol Pharmacol 2015 ; 28: 426-33.
4.Lankaputhra WEV: Survival of Lactobacillus acidophilus and Bifidobacterium ssp. in the presence of acid and bile salts. Cult Dairy Prod J 1995; 30: 2–7.
5.Gough E, Shaikh H, Manges AR: Systematic review of intestinal microbiota transplantation (fecal bacteriotherapy) for recurrent Clostridium difficile infection. Clin Infect Dis 2011; 53: 994–1002.
6.Konturek PC, Haziri D, Brzozowski T, et al: Emerging role of fecal microbiota therapy in the treatment of gastrointestinal and extra-gastrointestinal diseases. J Physiol Pharmacol 2015; 66: 483–91.
7.Gregor Reid: Potential ues of probiotics in clinical practice. Clin Microbiol Rev 2003; 16; 658–72.
8.Bertazzoni Minelli E, Benini A: Relationship between number of bacteria and their probiotic effects. Microb Ecol Health Dis 2008; 20: 180-3.
9.譚健民:非酒精性脂肪肝疾病致病機制的探討〜著重於腸道菌群所扮演的角色,台灣醫界,2016; 60: 31-40.
10. 譚健民:益生菌在消化系統疾病診治上所扮演角色的今日觀,台北市醫師公會會刊,2016; 60: 31-40.
11. 譚健民:益生菌在臨床診治上所扮演角色的現代觀〜著重於一種大腸內益生菌灌注的新興療法之探討,2016年07月號永信藥訊電子報。http://www.ysp.com.tw/ysp/Product-Medicine-01.aspx?tc=6b&volumn=201607&sn=5
12. Islam SU: Clinical Uses of Probiotics. Medicine Baltimore 2016; 95: e2658.
13. Hill C, Guarner F, Reid G, et al: Expert consensus document. The International Scientific Association for Probiotics and Prebiotics consensus statement on the scope and appropriate use of the term probiotic. Nat Rev Gastroenterol Hepatol 2014; 11: 506–1 4.

本文轉載自 KingNet國家網路醫藥
留言
張貼留言